外泌体表面修饰试剂盒(蛋白靶向)
保存与应用
【保存条件】
干冰或冰袋运输,收到试剂盒后按不同组分分别在 2-8℃或-20℃下保存。有效期 6 个月, 使用前请详细阅读说明书。
【应用范围】
本产品只用于科学研究,不能用于临床诊断和治疗。
产品介绍
外泌体(Exosome)是由不同细胞分泌的直径 30-150nm 的胞外膜性囊泡。外泌体内容物丰 富,包括蛋白质、脂质和核酸等,在细胞间信息交流中发挥着重要作用,并与多种疾病的发 生、发展、治疗及预后密切相关。
作为天然的胞间信息载体,外泌体免疫原性低,生物相容性高,在人体血液中比较稳定。 能够利用增强渗透滞留效应(Enhanced Permeation and Retention effect,EPR),有选择性的 渗透和滞留在肿瘤或炎症组织部位,可穿透血脑屏障等。不仅可以通过其内源内容物直接对 受体细胞进行治疗,也可以作为药物载体,递送化学药物、蛋白质、多肽及基因药物,在医 疗领域具有巨大的应用潜力。
为了增强外泌体的治疗效果,降低对正常细胞的毒害,需提高外泌体的靶向递送能力, 目前科研常用方法是基因改造分泌外泌体的细胞,利用重组克隆质粒,在细胞中表达靶向蛋 白或多肽-外泌体膜蛋白复合体,收集释放的外泌体,来获得靶向外泌体,但该方法修饰效 率低,且部分细胞转染困难,难以大规模制备。
本试剂盒避开繁琐的基因克隆步骤,通过点击化学反应,直接在提取的外泌体表面修饰 目标蛋白。首先将点击化学 linker A 分子共价偶联在外泌体表面,形成 exo-linker A,点击化 学 linker B 分子与靶向蛋白共价偶联,形成 pro-linkerB,各自纯化,去除剩余的 linker 分子。 然后将 exo-linker A 和 pro-linker B 孵育,两个 linker 之间发生快速高效的点击化学反应,以 共价键形式将目标蛋白偶联在外泌体表面,最后采用 SEC 分子排阻柱将剩余的 pro-linker B 去除,得到大量纯净的修饰外泌体。
本试剂盒表面修饰效率高,反应条件温和,生理条件下即可发生反应,反应特异性好, 无有害副产物,不需额外添加催化剂或其他化学物质,不会损伤外泌体膜结构,也不影响目 标蛋白的生物活性和功能,为靶向外泌体提供了一种高效、简便的修饰手段,可实现靶向外 泌体的大规模制备。
试剂盒组成和说明
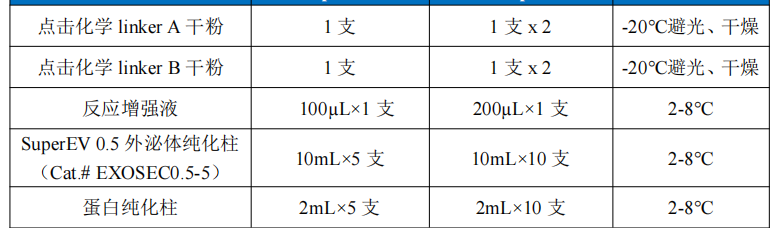
注意:两种纯化柱内均含有保存液,请竖立保存。
需自备的试剂和设备
1. 二甲基亚砜(DMSO)
2. PBS 缓冲液(pH 7.2-7.6)
3. 目标蛋白(不低于 0.2mg/mL)
4. 0.22um 滤膜
5. 收集管(烧杯,2mL 和 mL 离心管)
6. 旋转混匀仪或震荡混匀仪
7. 恒温培养箱(37℃)
【注意事项】
1. 点击化学 linker A 和 linker B 易水解,使用前需室温放置 10 分钟,平衡至室温,避免冷 凝水凝结,使用后请立即盖好旋紧,用封口膜密封。
2. 外泌体和蛋白缓冲液中避免含有 Tris、甘氨酸等含有胺的物质。
3. 可以对任何来源的外泌体进行修饰,包括细胞培养液和体液(如,血清、血浆、尿液、 CSF 或唾液等) 提取的外泌体。
4. 不建议使用 PEG 沉淀法提取的外泌体,推荐使用超速离心法、亲和色谱法、SEC 分子 排阻色谱法或磁珠捕获等方法提取的外泌体。
5. 为达到较好的体内浓度和靶向效果,外泌体浓度不得低于 5×1010颗粒数/mL。
6. 目标蛋白浓度请勿低于 0.2mg/mL,外泌体修饰效率会随着蛋白浓度的减少而降低。
7. 本试剂盒为非无菌操作,在进行下游细胞实验或体内实验前,必须将修饰好的外泌体进 行 0.22um 滤膜过滤,以达到无菌状态。
8. 本试剂盒未开封前的有效期为 6 个月,请在有效期内使用。
操作方法
一、实验前准备
1. 冻干粉 linker A 和 linker B 溶解
将 linker A 和 linker B 置于室温中放置至少 10 分钟,充分平衡至室温。打开封口膜,在 每个管中加入 60µL 二甲基亚砜(DMSO),上下吹打使其充分混匀,制备成 5mM 的 linker A 和 linker B,盖好旋紧,等候下步使用。
2. 计算 5mM linker B 加入靶蛋白溶液中的量
每个反应中 linker B 的使用量,取决于目标蛋白的使用浓度。通常,linker B 和目标蛋 白的摩尔比为 5:1 时,能达到较理想的效果。 以浓度 1mg/mL 靶蛋白(分子量 Mr)为例,200µL 中加入 5mM linker B 的计算方法:
1)计算 1mg/mL 靶蛋白(分子量 Mr)的摩尔浓度(mM): 1mg/mL Mr ×1000= mM
2)1mg/mL 靶蛋白,200µL,应加入 5mM 的 linker B 溶液体积: mM×51×200µL × 1 5mM= µL
计算示例:
1mg/mL 的 IgG(分子量 150KDa)溶液,200µL 中需加入 5mM linker B 的量为 1.33µL。
1)1mg/mL 150,000×1000= 0.00667mM
2)0.00667mM×51×200µL × 1 5mM=1.33µL
3. SuperEV 0.5 外泌体纯化柱和蛋白纯化柱室温平衡 从冰箱中取出 SuperEV 0.5 外泌体纯化柱和蛋白纯化柱,垂直固定,如果无合适的垂直固定装置,可从我公司购买配套的固定组件(货号:HCS1012),室温放置至少 30 分钟,使柱子充分平衡至室温。
注意:
柱子平衡至室温前,不要打开顶盖和底盖。
柱子第一次使用,上筛板与填料表面可能存在间隙,这是储存过程中填料沉降造成 的,不影响分离性能,实验前将筛板向下垂直推到填料表面即可。
二、外泌体偶联 linker A,靶向蛋白偶联 linker B
1. 外泌体偶联 linker A
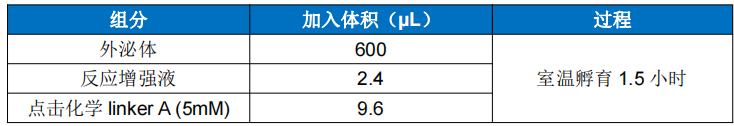
取 600µL 外泌体至 2mL 离心管中,加入 2.4µL 反应增强液,吹打混匀,再加入 9.6µL 5mM 的 linker A,吹打混匀,置于旋转混匀仪或震荡混匀器上,室温震荡孵育 1.5 小时, 即得到 exo-linker A 反应物。
2. 蛋白偶联 linker B
根据靶向蛋白浓度,计算 5mM linker B 的加入量,使 linker B 与蛋白的分子摩尔比为 5:1。取 200µL 靶向蛋白(缓冲液最好为 PBS)至 2mL 离心管中,再加入 linker B,吹打混 匀,置于旋转混匀仪或震荡混匀器上,室温震荡孵育 1.5 小时,得到 pro-linker B 反应物。

三、exo-linker A 和 pro-linker B 的纯化
1. 纯化柱柱平衡(可在外泌体或靶向蛋白孵育 linker 时完成)
1)将收集管(烧杯或普通离心管)放置在 SuperEV 0.5 外泌体纯化柱和蛋白纯化柱下 方,打开顶盖,用移液器吸弃上方的保存液。
2)外泌体纯化柱取下底盖,分次共加入 20mL PBS 冲洗柱子。
3)蛋白纯化柱取下底盖,分次共加入 4mL PBS 冲洗柱子。
4)冲洗过程始终保持顶部筛板湿润,避免柱体变干。冲洗完成后,盖上底盖,加入少量 PBS 等待后续操作
2. exo-linker A 纯化(去除游离的 linker A 分子)
1)使用冲洗后的 SuperEV 0.5 纯化柱进行纯化,吸弃纯化柱筛板上方的 PBS,取下 柱子底盖,下方放置 5mL 离心管。
2)将 exo-linker A 反应物混匀,瞬时离心,使液体全部集中在管底。
3)在筛板上方加入全部的 exo-linker A 反应物(约 600µL),待样品全部进入筛板, 出口无液体流出时,加入 2.9mL PBS,当液体全部流出后,收集完毕。该馏分大约 3.5mL,不含外泌体,可直接丢弃。
4)继续加入 1.2mL PBS 洗脱,用 2mL 离心管收集馏分。待出口无液体流出时,该馏 分收集完毕。exo-linker A 集中在该馏分,可用于下步操作。
5)收集完毕后,用 20mL PBS 对柱体进行冲洗,冲洗后的柱子加入少量 PBS,盖上 底盖,等待后续操作。
3. pro-linker B 纯化(去除游离的 linker B 分子)
1)使用冲洗后的蛋白纯化柱进行纯化,吸弃纯化柱筛板上方的 PBS,取下柱子底盖, 下方放置 2mL 离心管。
2)将 pro-linker B 反应物混匀,瞬时离心,使液体全部集中在管底。
3)在筛板上方加入全部的 pro-linker B 反应物(约 200µL),待样品全部进入筛板, 出口无液体流出时,加入 550µL PBS。当液体全部流出后,收集完毕,该馏分大约 750µL,不含蛋白,可直接丢弃。
4)继续加入 300µL PBS 进行洗脱,用 2mL 离心管收集馏分。待出口无液体流出时, 该馏分收集完毕。pro-linker B 集中在该馏分,可用于下步操作。 5)收集完毕后,柱子可直接丢弃。
四、exo-linker A 和 pro-linker B 点击化学反应及纯化
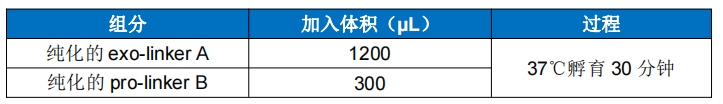
1. exo-linker A 与 pro-linker B 点击化学反应 将 300µL 纯化 pro-linker B 加入到 1200µL 纯化 exo-linker A 中,吹打混匀, 37℃孵 育 30 分钟。
2. 纯化(去除未结合的 pro-linker B)
1) 使用上面冲洗后的 SuperEV 0.5 外泌体纯化柱进行纯化,步骤同前。
2) 吸弃纯化柱筛板上方的 PBS,取下柱子底盖,下方放置 5mL 离心管。
3) 将点击化学反应混合物混匀,瞬时离心,使液体全部集中在管底;
4) 在筛板上方加入 750µL 的点击化学反应混合物,待样品全部进入筛板,出口无液体 流出时,加入 2750µL PBS。液体全部流出后,收集完毕。该馏分大约 3.5mL,不 含外泌体,可直接丢弃;
5) 继续加入 1500µL PBS 进行洗脱,用 5mL 离心管收集馏分。待出口无液体流出时, 该馏分收集完毕。修饰的靶向外泌体收集在该馏分;
6) 收集完毕后,用 20mL PBS 对柱体进行冲洗;
7) 冲洗完毕后,继续将剩余的 750µL 的点击化学反应混合物加入纯化柱中,进行纯化, 步骤同 4)和 5)。
8) 收集完毕,柱子可直接丢弃。
9) 本试剂盒操作过程不是无菌操作,在进行下游细胞实验或体内实验前,必须将修饰 的外泌体进行 0.22um 滤膜过滤,以保证无菌。
用途:该产品仅供科研实验使用,未经允许不得用于其它用途!以实际收货产品说明书为准,网站说明书仅供参考。
 在线客服1号
在线客服1号